2025年7月,“全球首个”中美药监局双报双批注册临床试验——“临床级iPSC衍生亚型脊髓神经前体细胞治疗脊髓损伤”项目完成里程碑进展:由士泽生物自主研发的“全球首款”异体通用“现货型”iPSC再生脊髓神经细胞新药(XS228细胞注射液)治疗重大神经系统疾病脊髓损伤的注册临床I期研究,在中山大学附属第三医院(中山三院)召开临床启动会,并成功完成“全球首例”受试者给药。
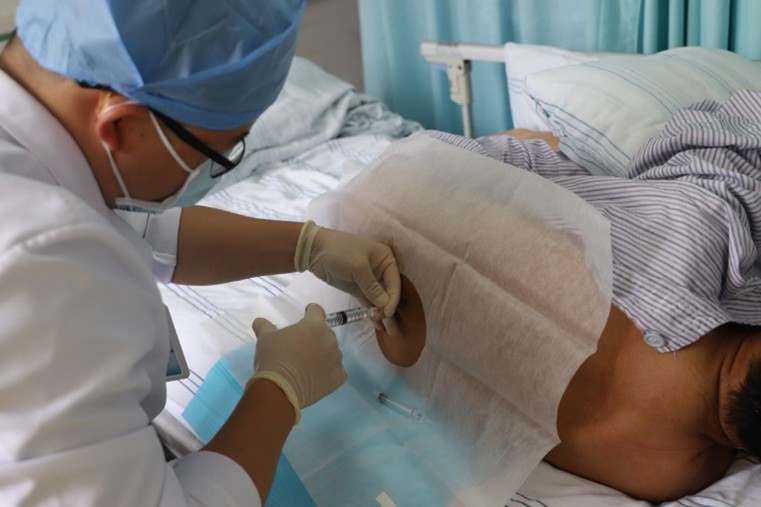
注册临床试验首例受试者接受临床级iPS再生脊髓神经细胞移植后,无手术及围术期的并发症或其他不良安全事件,各项检测指标正常,平稳度过观察期并进入正式随访期。

士泽生物自主研发的“全球首款”异体通用“现货型”iPSC再生脊髓神经细胞新药治疗重大神经系统疾病脊髓损伤的注册临床I期研究的临床合作方为国内脊髓损伤诊疗领域顶级医院及专家团队:
牵头临床单位:中山大学附属第三医院,由脊髓损伤诊疗领域权威专家、骨科学科带头人戎利民院长及其团队
联合临床单位:大连医科大学附属第一医院及大连干细胞与精准医学创新研究院,由党委书记、院长刘晶教授及其团队
中山大学附属第三医院院长戎利民教授在注册临床启动会表示:由中山大学附属第三医院牵头开展的全球首个iPSC衍生亚型特异性神经细胞的脊髓损伤治疗临床试验现已正式启动,标志着再生医学领域迈入全新阶段的重要里程碑。该研究有望为长期缺乏有效干预手段的脊髓损伤患者,提供一种具有突破创新价值的“现货型”细胞治疗新选择。
本次临床试验将与大连医科大学附属第一医院紧密协作,充分发挥双方在中枢神经疾病临床研究方面的雄厚实力与平台资源,确保试验按国际高标准、高质量推进。我们致力于构建具有全球引领力的“中国方案”,为中枢神经系统再生修复开辟创新路径。
大连医科大学附属第一医院党委书记刘晶教授在注册临床启动会表示:iPSC衍生亚型神经细胞国家Ⅰ类新药成功通过中美“双报”注册审批,标志着我国在干细胞药物研发与临床转化领域跻身世界前沿,体现了中国原创生物医药在国际舞台上的竞争力与影响力。
新技术的临床价值落地,离不开高水平临床研究的支撑。本次临床研究选址中山大学附属第三医院与大连医科大学附属第一医院,既是对两家单位在干细胞研发能力、临床管理体系等方面的高度认可,也将成为对粤辽两地干细胞治疗体系建设成效的重要检验。
大医一院将与中山三院紧密协同,推进项目规范有序实施,力求以高水平、高质量的研究实践,为中枢神经损伤修复领域的全球突破贡献兼具科学性与创新性的“中国方案”。
全球脊髓损伤患者群体人数众多(约1500万人),其中,中国脊髓损伤患者超过300万,每年新增急性/亚急性损伤病例10万例,平均每小时新增10例脊髓损伤患者。脊髓一旦受损,极易造成患者全身或部分瘫痪、失去运动和感觉功能,包括四肢瘫痪(高位损伤)或下肢瘫痪(低位损伤),多数患者终身残疾,严重影响生活质量。由于中枢神经系统再生能力极低,神经修复极为困难,目前治疗手段仍以康复训练和辅助支持为主,缺乏损伤期神经再生修复方法。
本项中美药监局双报双批的注册临床试验完成“全球首例”患者给药,是全球中枢神经损伤修复领域的重要里程碑,对探索再生脊髓神经细胞移植治疗脊髓损伤的安全性并分析对脊髓损伤患者疗效的影响具有重要的标杆意义。
士泽生物创始人李翔博士表示:“全球首例”脊髓损伤患者接受脊髓特化再生神经细胞治疗已在中国顺利实施,标志着该领域实现了具有里程碑意义的突破,开创了行业发展的新篇章。我们对此充满信心,并将继续推动异体通用“现货型”iPSC衍生亚型神经细胞技术、新药开发和临床研究的协同进步,力争在以脊髓损伤为代表的中枢神经损伤修复治疗领域实现进一步突破,积极争取该领域的全球话语权。
士泽生物为国内细胞治疗帕金森病的领军药企,由士泽生物创始人李翔博士于2021年全职归国创立。士泽生物专注于开发临床级、异体通用、“现货型”iPSC衍生细胞药用于治疗神经系统疾病(CNS Diseases),并已经实现了显著的领先优势:
士泽生物已获得中国国家药监局(NMPA)和美国食品药品监督管理局(U.S.FDA)正式批准的七项中美注册临床试验批件,多款通用型iPSC衍生神经细胞新药已处于中美注册临床试验阶段,包括用于治疗:
全球第二大神经退行性疾病原发性帕金森病(中美注册临床I期);早发性帕金森病(中国注册临床I/II期);重大神经系统疾病脊髓损伤(中美注册临床I期);肌萎缩侧索硬化症/渐冻症(中国注册临床I/II期及美国注册临床I期),为中国首个自主iPSC衍生细胞药获美国FDA认证并授予全球孤儿药资格。
在通用iPSC细胞治疗帕金森病赛道方向上,士泽生物率先取得多项领域突破进展,与国内最顶级医院帕金森病专家联合开展注册临床试验合作:
2024年,“中国首个”iPSC衍生细胞治疗神经系统疾病的国家级备案临床研究获批,与上海市东方医院刘中民院长团队合作,完成包括“中国首例”在内的多例帕金森病患者GCP/GMP级细胞治疗,随访超过12个月:安全性良好,患者“开关期时间”、MDS-UPDRS评分及多项非运动指标显著改善,多例患者反馈明显的生活质量提升,并通过国家卫健委GCP/GMP规范双核查;
2025年,美国食品药品监督管理局(FDA)已一次性无发补完全正式批准了士泽生物的通用型iPSC衍生多巴胺能神经前体细胞注射液的研究性新药申请(Investigational New Drug, IND),用于治疗美国帕金森病的注册临床I期试验。同月,美国FDA批准美国BlueRock Therapeutics公司(已于2019年被德国拜耳集团全资收购)通用细胞治疗帕金森病直接豁免注册临床II期、进入确证临床III期试验。
2025年,“中国首个”由国家级神经疾病医学中心——北京天坛医院冯涛主任牵头,联合北京协和医院包新杰主任/王任直主任/王含主任开展的异体通用“现货型”iPSC衍生多巴胺能神经前体细胞(XS411注射液)注册临床I期试验,用于治疗全球第二大神经退行性疾病原发性帕金森病;
2025年,“中国首个”采用证据级别最高的“随机双盲对照”设计的注册临床I/II期试验,由复旦大学附属华山医院(同为国家级神经疾病医学中心)王坚主任/陈亮主任/张菁主任牵头,联合苏州大学附属第二医院刘春风主任开展,用于治疗早发性帕金森病(EOPD)。
此外,士泽生物开发的其他异体通用iPSC细胞治疗神经系统疾病新药同样取得了具有突破性意义的里程碑进展,处于“全球首款”及“全球首创”地位:
2023年,“中国首个”iPSC衍生细胞药(XS228注射液)获得美国FDA认证并授予全球孤儿药资格;
2024年,“全球首款”iPSC衍生细胞(XS228注射液)治疗渐冻症(ALS)的国家级备案临床研究获批,与东方医院合作完成包括“全球首例”在内的多例患者治疗,安全性良好,初步显示可有效延缓疾病进程;
2025年,“全球首个(FIC)”异体通用“现货型”iPSC衍生亚型神经前体细胞新药的注册临床I期试验,由中山大学附属第三医院戎利民院长牵头,联合大连医科大学附属第一医院刘晶院长开展,用于治疗重大神经系统疾病脊髓损伤(SCI),完成“全球首例”再生亚型神经细胞治疗脊髓损伤患者给药。
2025年,“全球首个(FIC)”异体通用“现货型”iPSC衍生亚型神经前体细胞新药(XS228注射液)的注册临床I/II期试验,由北京大学第三医院樊东升主任牵头,用于治疗“世界四大绝症之一”渐冻症(ALS)。
士泽生物为江苏省双创团队领军企业,姑苏重大创新团队企业、姑苏创新创业领军人才企业、上海市东方英才计划企业、上海市春申计划杰出引进人才企业等;连续获评中国潜在独角兽及江苏省潜在独角兽企业;连续两年获得国家科技部全国颠覆性技术创新大赛优胜奖(最高奖)等;获我国《新华日报》《科技日报》《科创板日报》等多次报道。
士泽生物已完成由顶级市场化风险投资机构集体领投的多轮数亿元融资:由峰瑞资本、启明创投、礼来亚洲基金、红杉中国、泰珑/泰鲲资本等多家知名市场化机构领投及多轮持续投资,其中包括2022-2025年在生物医药领域寒冬期的4亿元A1/A2/B1/B2轮市场化融资。