对于亚盛而言,多个产品处于临床阶段,并且均看到一定积极的疗效和安全性信号,显然推动临床进展是其现阶段首要任务。
撰文 | 程昊红
亚盛医药日前宣布公司重要在研产品APG-2575再下一城,其在中国又获批一项Ib/II期临床试验批件。在此之前的一个月内,APG-2575已接连获得中美三项临床试验许可,呈逆势加速态势。而在一周前,亚盛医药发布2019年公司年报,在其年报中有个数据非常亮眼:公司有8个1类新药在临床阶段,在中国、美国、澳大利亚三地正在开展的I/II期临床研究数量已超过30个,意味着全球开发全面推进。
而去年10月,亚盛实现了香港上市,并在上市之后不久,正式宣布在苏州奠基公司全球总部、研发中心及产业基地。高速推动的临床研发进度、一系列引人瞩目的动作,预示着亚盛进入全新的发展阶段。
事实上,亚盛专注的细胞凋亡领域,目前只有艾伯维/基因泰克开发的Bcl-2抑制剂Venetoclax于2016年获批上市,可谓20年磨一剑。Venetoclax在2019年销售额超过10亿美元,未来预计峰值年销售可达60亿美元。拥有可观市场前景的研究领域,却因为研发难度,多年来让业界望而却步。
为通关这一药物开发高难领域,亚盛启动了覆盖较为完整的产品线布局,并逐步加速这些全新机制产品的临床进度。同时凭借对下一代激酶抑制剂的多元化布局,公司亦有望两年内迎来首个商业化产品。
拓展阅读:一种坚守:Bcl-2抑制剂开发沉浮30年
细胞凋亡通路全面布局
细胞凋亡领域从机理发现到第一个产品上市历时30余年,Venetoclax开发者艾伯维为推动产品开发还发明了药物设计的全新方法学——以片段为基础的药物设计(FBDD),细胞凋亡尤其是Bcl-2靶点领域药物开发的艰难可见一斑。
在亚盛共同创始人、董事长兼CEO杨大俊看来,细胞凋亡药物开发有3方面挑战:一、从细胞凋亡通路药物设计来讲,蛋白-蛋白相互作用是非常高难的靶点;第二、Bcl-2的结合口袋较大,很难设计出小分子阻断整个结合口袋;第三,Bcl-2靶点在线粒体膜上,存在药物输送问题,进一步增加了成药难度。
以Bcl-2家族蛋白为靶点的药物研发多年来被证实极其困难,但2016年4月在美国成功上市的Bcl-2选择性抑制剂Venclexta为该靶点药物的开发提供了强有力的临床验证依据。
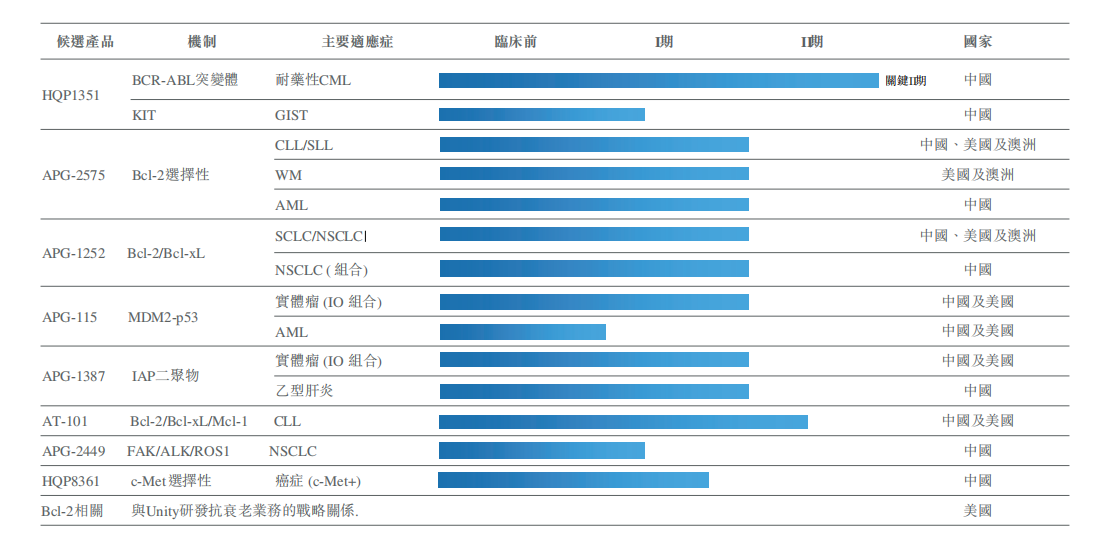
亚盛核心团队在细胞凋亡领域坚持研发20多年,目前公司在该领域的布局非常全面,其系列产品线上共有5个产品,分别为Bcl-2选择性抑制剂APG-2575、Bcl-2/Bcl-xL抑制剂APG-1252、IAP抑制剂APG-1387、MDM2-p53抑制剂APG-115和泛Bcl-2抑制剂AT-101。目前这些在研产品均向临床Ⅰb/Ⅱ期或者Ⅱ期推动中。
Bcl-2选择性抑制剂APG-2575是在全球层面继Venclexta之后罕有的进入临床开发阶段的Bcl-2选择性抑制剂,可谓直接对标Venclexta。亚盛开展的早期研究发现,APG-2575的半衰期比较短,在临床设计上采用每天剂量递增。由于Bcl-2靶点的特性,诱导癌细胞凋亡之后,在组织中停留时间越短,越有利减少副作用,因此,在安全性和用药便利性方面,半衰期短成为APG-2575相较Venetoclax的一项优势。APG-2575去年在中国启动血液肿瘤的I期临床研究,成为首个进入临床阶段的国产Bcl-2选择性抑制剂。
此前,APG-2575针对治疗血液肿瘤的I期临床试验已在美国和澳大利亚启动。公布的临床结果显示,迄今未观察到任何剂量限制性毒性(DLT)以及Bcl-2抑制剂常见的肿瘤溶解综合征(TLS),证实了良好的安全性。正是基于APG-2575良好的临床前数据及早期临床数据,亚盛医药针对APG-2575在联合CD20 单抗、BTK抑制剂等药物治疗多个血液肿瘤适应症的Ib/ II期研究接连获得中美两国药监部门的临床许可。
Bcl-2/Bcl-xL抑制剂APG-1252目前在中美澳三地推动临床,主要的方向是单药或联合治疗小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC)。
谈到APG-1252以SCLC这一独特适应症入手,杨大俊表示,选择性靶向Bcl-2的产品主要用于血液肿瘤,是因为实体瘤中有Bcl-xL蛋白表达,单独抑制Bcl-2,对实体瘤没什么效果。双靶点的APG-1252,可以同时抑制两个靶点,临床前的数据也显示,APG-1252单药对SCLC比较敏感;另外,SCLC中第三号家族蛋白MCL-1表达相对比较低,不会对产品疗效有太大影响;而SCLC也是临床挑战非常大,目前缺乏有效药物的瘤种。
选择较为独特适应症的策略在IAP抑制剂APG-1387的开发上也有体现。在实体瘤之外,APG-1387还在中国开展了治疗乙肝的临床,目前已经完成了Ⅰb期研究。APG-1387治疗乙肝的机理是可有效抑制肝细胞中的IAPs表达,促进病毒特异性T细胞介导的HBV DNA和HBV表面抗原的消除,从而达到功能性治愈慢性乙肝。IAP抑制剂用于治疗乙肝病毒感染的优势在于,依靠特异性T细胞的识别能力,能优先杀死感染细胞而不影响健康细胞。拥有全新的作用机理,也让APG-1387有跟核苷类药物及RNAi产品联合的可能。
而MDM2-p53抑制剂APG-115Ⅰb/Ⅱ目前正在中美两地进行两项单药治疗晚期实体瘤或淋巴瘤患者的I期临床试验。同时,APG-115联合帕博利珠单抗的Ⅱ期临床试验也在美国进行中。
在覆盖诸多潜力靶点之外,产品为中国唯一或第一也是亚盛在布局细胞凋亡产品线时的重要策略。以APG-115为例,APG-115在2017年7月即获得CDE批准开展临床,而罗氏同类产品Idasanutlin在2019年7月临床申请才获受理。
抓住联合治疗机遇
在亚盛细胞凋亡产品线布局中,联合治疗的诸多合作也格外引人注目。
如去年4月,亚盛与君实生物合作探索APG-1387+PD-1单抗特瑞普利联合用药方案;2018年12月,与嘉和生物合作探索APG-115+PD-1抑制剂杰诺单抗(GB226)的联合方案;APG-115与APG-1387也均有联合帕博利珠单抗的临床在进行中。
联合治疗已然是肿瘤药物开发领域公认的未来趋势,以细胞凋亡产品联合免疫治疗是其中一个重要方向,显然也成为亚盛的发展策略之一。
杨大俊从机理角度进行了解释:诱导凋亡的小分子药物,除了诱导肿瘤细胞凋亡,杀伤肿瘤细胞,还有一个很重要的功能是免疫调节,比如增加T细胞、巨噬细胞的调整等。细胞凋亡药物与PD-1抑制剂联合,可以把阻碍PD-1抑制剂发挥作用的抑制因素去除掉,因此是相对合适的联合方案。
事实上,不仅仅PD-1单抗钟意联合细胞凋亡产品,笔者此前采访中了解到很多BTK抑制剂也以联合Bcl-2抑制剂作为发展重要方向,这也可能为产品线丰富的亚盛后续合作带来了很多独家的优势和机会。
下一代激酶抑制剂逆袭
在亚盛进入临床阶段的8个产品中,除了5款细胞凋亡产品,还有3款下一代激酶抑制剂,其中第三代BCR-ABL/KIT抑制剂HQP1351有望成为亚盛首个实现商业化的产品。
HQP1351主要针对格列卫耐药的慢性髓性白血病(CML)患者,尤其是T315I突变患者(T315I突变是最为常见的耐药类型之一,发病率约20%),全球只有一款同类的三代产品普纳替尼上市。
HQP1351目前在中国开展了针对耐药CML的Ⅱ期关键注册临床和胃肠道间质瘤(GIST)的Ⅰ期临床,并在2019年7月,获FDA批准直接进入Ⅰb期临床。
杨大俊表示,FDA批准产品直接进入Ⅰb期,一方面基于产品的数据,HQP1351在中国已经完成了100多例患者的Ⅰ期临床,剂量爬坡和扩增中设立3个剂量组,每个剂量组纳入20余位患者,Ⅰ期临床的数据比较完整充分;另一方面是考虑美国的患者,没有必要从Ⅰ期开始进行最低剂量爬坡。
此前,亚盛连续两年(2018、2019年)在美国血液病学会(ASH)年会上公布HQP1351的1期临床进展:针对一代、二代TKI耐药的CML患者,包括处于慢性期(CP)和加速期(AP)的不同患者。CP患者完全血液学缓解(CHR)率为95%,主要细胞遗传学缓解(MCyR)率为69%,37%达到主要分子学反应(MMR);携有T315I的CP患者, MCyR率高达82%。AP患者CHR为85%,MCyR为43%。与同类普纳替尼相比,效果具有可比性,安全性更好。
这也助推HQP1351很快成为亚盛的核心产品之一。
2018年12月,亚盛与CDE沟通HQP1351的Ⅱ期临床方案,并获准在完成Ⅱ期试验后即可提交新药上市申请(NDA)。据了解,这项关键注册Ⅱ期已在9月完成60例患者入组,计划2020年6月左右递交NDA申请,有望2021年正式获批上市。
2020临床进度条
对于亚盛而言,多个产品处于临床阶段,并且均看到一定积极的疗效和安全性信号,显然推动临床进展是其现阶段首要任务。
在3月30日的2019业绩发布电话会上,杨大俊即表示,亚盛在这一年中希望达成以下几个重要的临床节点:第一,递交HQP1351的NDA申请;
第二,APG-2575近期已获得FDA两项IND许可,分别为单药或联合治疗复发/难治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)和华氏巨球蛋白血症(WM)的全球Ib/II期临床研究,其中,治疗CLL/SLL的临床研究已完成美国首例患者给药。同时获得CDE一项IND许可,单药或联合治疗复发/难治性急性髓系白血病(AML)的Ib期研究(编者注:截至发稿,亚盛医药APG-2575又获得CDE一项新的IND许可,单药或联合治疗复发/难治CLL/SLL的Ib/II期临床研究)。这三个适应症均是相应靶点领域证实有效的,艾伯维同类产品Venetoclax主要的适应症就是这三个。公司希望取得进一步进展。
第三,APG-115、APG-1387均开展了与帕博利珠单抗即K药的临床Ib联合研究,临床上,两个产品在耐药的复发难治性的最晚期癌症患者中均看到CR或PR的病例。如APG-115的联合研究中,入组的19例患者中14例可以评估,1例卵巢癌患者达到CR,两例达到PR,其中包括一位接受多种治疗无效的、使用了PD-1抗体复发的NSCLC患者。公司希望这两个产品在后续扩大人群的研究中有进一步进展。
最后,APG-1387针对乙肝适应症已完成Ib期临床,在一周一次给药(给药4周),观察3个月后,4个剂量组中,接近90%患者DNA水平下降,60%以上表面抗原下降。公司已经递交Ⅱ期临床申请。
迈向完整制药企业
2019年10月28日,亚盛正式登陆港交所,并且实现超购达751倍。随后,亚盛就在苏州启动全球总部、研发中心、产业基地的大手笔工程。这显然是其进入快速发展阶段的重要标志。
据了解,公司将按照国际cGMP标准建立全球生产基地,为后续进入全球医药市场提供支持。而厂房建设项目一期完成后,口服固体产能为1.3亿片或粒以上;全部项目建成后,口服固体产能为5亿片或粒以上,冻干粉针2000万瓶以上。
在商业化方面,亚盛未来的整体布局是从研发走向生产、销售,长期会建立自己的销售团队,打造完整的制药企业。但短期内,亚盛比较开放,会积极需求各类形式的合作。
杨大俊表示,公司定位于全球创新与全球市场,“中国创新药企出海有三个很重要的核心因素:第一,要有全球的专利保护,我们的每一个药,都是基于结构的专利,目前在全球已经获得了80项专利授权;第二,在开发过程中,尤其临床开发的过程需按照国际标准,特别通过公认最难的美国FDA的认可,我们在美国已获得8个IND,将进一步推进全球层面的临床开发;第三就是符合前面两点后,还需具备商业化能力。”