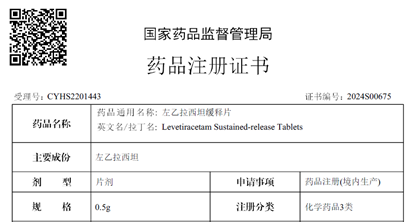
近日,越洋医药自主研发的左乙拉西坦缓释片(500mg)获得国家药品监督管理局(NMPA)上市批准,批准文号:国药准字H20243583,该产品为《国家基本医疗保险、工伤保险和生育保险药品目录》医保乙类产品。左乙拉西坦作为多国指南推荐的抗癫痫优选药物,可用于癫痫的单独治疗,其缓释制剂为每日一次服药,避免了因普通制剂血药浓度波动而引起的癫痫发作风险。此规格的获批标志着中美双报双获批圆满收官。2022年左乙拉西坦全球销售额超25亿美元,中国销售额近10亿元,中国院内销售额增长达13%左右。目前此产品正在寻找中国和其他国家的商业化合作伙伴。
公司召开了产品获批庆功会,会上项目组成员纷纷发表了获奖感言,表达对公司的祝贺和感激。公司首席技术官范军博士发言讲述了产品从研发、生产、临床到注册申报、FDA现场核查及缺陷信答复的种种挑战,获批是起点也是公司转型商业化的开始,这是大家齐心协力、团结一致的结果。最后,越洋创始人、董事长兼CEO闻晓光博士表达了对全体越洋人的感谢,强调虽然实现了中美双报双获批“零”的突破,但这只是万里长征迈出的第一步,强调越洋人要继续秉承只为成功找出路不为失败找借口的工作理念,不忘初心,真正把缓控释新药在中美等多国获批上市,做到越洋销售全球,给患者带来疗效更优、副作用更小、顺应性更好的新药,这样公司才能做得更好、走得更远。



2011年12月成立,广州,江苏泰州和美国加州圣地亚哥拥有研发及中试放大基地,拥有多名全职欧美海归及本土骨干人才,拥有100+名员工及10000多平方米基地。20+新药获批中美临床批件,10+新药处于I期和III期临床阶段,一个缓控释产品在中国和美国获批上市许可。
主营业务
—上市许可持有人
应用越洋专有和通用缓控释技术开发针对美国市场的NDA(505(b)(2))申报路径)和中国市场的2类新药;委托生产,委托销售。
—产品开发技术服务
借助公司的专有平台技术(UC-trol®, Mech-trol®, Bi-lock®)以及通用平台技术(Multi-layer, Tablet-in-tablet, Osmotic Pump)服务客户,1)提高NCE的成药性;2)把客户的一代普通制剂进行迭代创新转化成缓控释新药,延长产品寿命,3)为国内外客户开发缓控释仿制药。
—产品共同开发
希望与值得信赖的合作伙伴共同开发已进入不同临床研究阶段的缓控释新药产品;联合开发在中美已获得临床试验许可的缓控释新药产品。公司产品涉及疼痛、失眠、癫痫、抑郁症、高血压、糖尿病、类风湿性关节炎等多个适应证领域。
—产品权益转让
国内外获批的临床批件,不同临床阶段的产品及生产批件转让给国内外药企,越洋医药获得转让费和销售提成。