近日,智康弘义宣布在2024年欧洲肿瘤学会(ESMO)年会上公布了全球独家开发的抗体偶联药物BC3195(CDH3 ADC)在I期临床试验中针对晚期实体瘤的安全性和有效性的最新临床数据。(临床试验信息:NCT05957471)
此次发布的数据显示,BC3195具有可控的安全性和良好的 PK 特征。BC3195在NSCLC患者中显示出显著的抗肿瘤活性,其总体缓解率(ORR)达到36.4%,尤其是对携带EGFR突变的患者ORR达到80%。BC3195目前正在进行临床I期剂量优化和扩展研究。
大会Poster展示期间,BC3195临床I期试验的研究结果受到众多参会者关注,该研究的主要研究者广东省人民医院终身主任吴一龙教授在现场与参会者交流讨论(上图)。
本次ESMO会议公司壁报展示的标题为“BC3195,一款全新靶向CDH3的抗体偶联药物用于晚期实体肿瘤的首次人体 I 期研究的初步结果”,主要内容如下:

截至2024年8月10日的数据截止日期,该I期临床研究共入组了34例患者(中位年龄59.5岁,男性占64.7%),均为经历多线治疗的晚期患者。其中0.3、0.6、1.2 和 1.8 mg/kg Q3W 剂量组四个剂量组各入组3例患者,2.4 mg/kg Q3W 剂量组入组21例患者,1.2 mg/kg QW 剂量组入组1例患者。
安全性结果
有效性结果
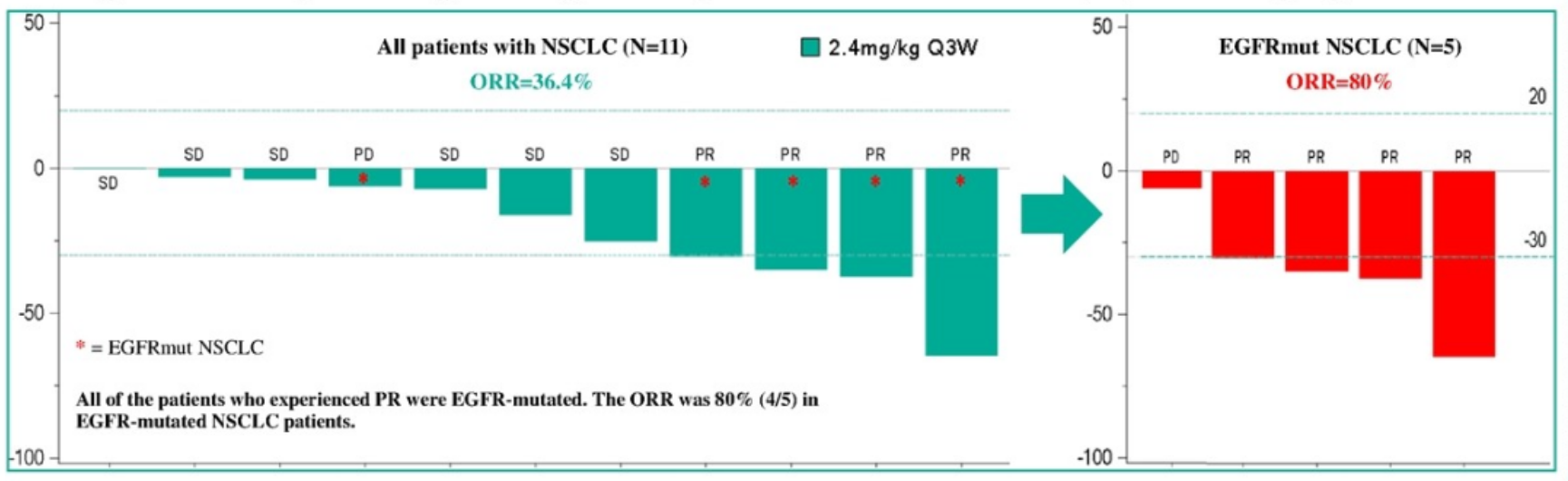
BC3195在 2.4 mg/kg Q3W剂量水平上
针对NSCLC的最佳疗效
基于BC3195已获得的优异临床结果,公司将继续与全球临床研究者们共同推进这款全球独家ADC的临床进展,尽早为肿瘤患者提供新的治疗选择。
BC3195是智康弘义全球独家开发的新一代靶向CDH3的抗体偶联药物,BC3195采用与CDH3蛋白具有较高亲和力并展现出良好内吞活性的抗体,同时采用经临床验证、具有“旁观者效应”的连接子和有效载荷vc-MMAE,以进一步提高临床开发成功率和满足未来不同场景临床需求。BC3195在临床前研究中表现出优异的肿瘤抑制活性,在多个肿瘤模型中的肿瘤生长抑制率大于100%。
BC3195目前正在中美同步进行开展I期剂量优化和剂量扩展研究。已有临床数据表明,BC3195具有可控的安全性和良好的PK特征,同时具有显著的抗肿瘤效果,在多个瘤种中观察到确认的PR。
“做好药,为生命更美好/Better Medicine for Better Life”,是智康弘义的崇高使命。
智康弘义成立于2017年12月,公司以患者和疾病为中心,高度重视疾病生物学在新药研制中的基础性作用,优先专注于肿瘤、肾病等疾病“BIC/FIC”创新药物的研发、临床试验和商业化。
自公司成立以来,在化学小分子、单克隆抗体、双特异性抗体、抗体偶联药物(ADC)等不同技术领域均进行了管线布局,凭借高效的研发和运营模式,目前已有多款新药处于I期/II期阶段,临床PI均由领域内顶级专家担任,临床试验的质量和进度延续了产品临床前研发的优势,均处于全球领先水平。
产品管线中,针对慢性肾脏病(CKD)进行开发的高选择性内皮素受体A(ETA)拮抗剂SC0062在临床II期2-SUCCEED研究中的IgA肾病试验已达到主要终点,基于该试验的优异结果SC0062已被CDE纳入突破性治疗品种名单;该研究中的糖尿病肾病(DKD)试验正在进行中,计划第四季度完成揭盲。下一阶段,公司目标于年内启动该项目的III期临床研究,旨在进一步扩大在CKD领域的领先优势。
公司全球独家开发的靶向CDH3的抗体偶联药物BC3195已在中美同步开展临床,全球首款靶向GPC3的抗体偶联药物BC2027也于近期获批美国临床,进一步加强了公司肿瘤管线在全球范围内的优势。此外,公司另有多款FIC的ADC和双抗产品处于临床前开发或Pre-IND阶段。
智康弘义已组建了一支多学科交叉背景的核心管理团队,领导公司全生命周期的研发业务,同时也配备了熟悉中美市场环境的运营团队,系统性地保证了公司全流程研发质量和效率。公司将进一步增强新技术和全球商业化的布局,以巩固公司领先的综合研发实力,助力拓展海外市场。
智康弘义正以“快速成长为中国领先,拥有持续创新能力、核心组合产品、多样化创新疗法,及深度商业化能力的生物医药公司”为目标,致力于更好、更多地造福全球患者,为中国生物医药产业的新一轮发展贡献力量。
往期回顾:
智康弘义高选择性ETA小分子拮抗剂SC0062获突破性治疗品种认定,用于治疗伴有蛋白尿的IgA肾病 | 项目进展
智康弘义宣布高选择性ETA拮抗剂SC0062临床II期2-SUCCEED研究IgA肾病试验达到主要终点 | 项目进展