
- 摘要 -
阿尔茨海默病(AD)是最主要的神经退行性疾病,Aβ(特别是Aβ42)是导致AD的重要成因。γ-secretase在Aβ的生成过程中发挥着重要作用,因此一直被人们视作抗AD药物研发的一个重要靶点。然而,分子量高达230kDa、多次跨膜且高度糖基化的γ-secretase给传统结构解析方法提出了重大挑战。近些年,施一公团队应用Cryo-EM SPA技术以3.4 Å分辨率解析γ-secretase的结构,并进一步解析了4种靶向药物与γ-secretase结合形成复合物的结构,为新一代药物的发现和优化提供了重要启示。
- 01 -
阿尔茨海默病(Alzheimer’s Disease, AD)是全球最主要的神经退行性疾病,患病人群的规模庞大。淀粉样斑块沉积是AD的两大病理特征之一,这些斑块主要由β-淀粉样小肽(β-amyloid, Aβ)沉积形成。自1991年发现淀粉样前体蛋白(Amyloid Precursor Protein, APP)突变参与家族性AD(FAD)发病以来,淀粉样蛋白级联假说就逐渐成为AD发病机理的主流理论,而早老素1(Presenilin 1, PS1)突变体的发现进一步支持了这一假说[1]。
Aβ是APP经由淀粉样生成途径被分泌酶切割产生的片段。在该途径中,APP的N端在质膜的胞外侧首先被β-分泌酶(β-secretase)切割,然后其C端的99个氨基酸残基(C99)会进一步被γ-分泌酶(γ-secretase)切割,产生胞内域和一个包含48或49个残基的跨膜区短肽(Aβ48或Aβ49)。Aβ48和Aβ49可继续被γ-secretase以消化3或4个残基的方式切割。其中Aβ49被切割后产生Aβ46,Aβ43和Aβ40。而Aβ48被切割后产生Aβ45,Aβ42和Aβ38[2]。人体中Aβ存在的最主要形式是Aβ40和Aβ42。由于这些Aβ片段几乎包含了APP这一单次跨膜蛋白的整个跨膜区段而具有很强的疏水性,所以极易聚集并在体内形成淀粉样纤维,进而沉积形成淀粉样斑块。其中,Aβ42和Aβ43最容易聚集并产生神经毒性,从而引起AD[3]。
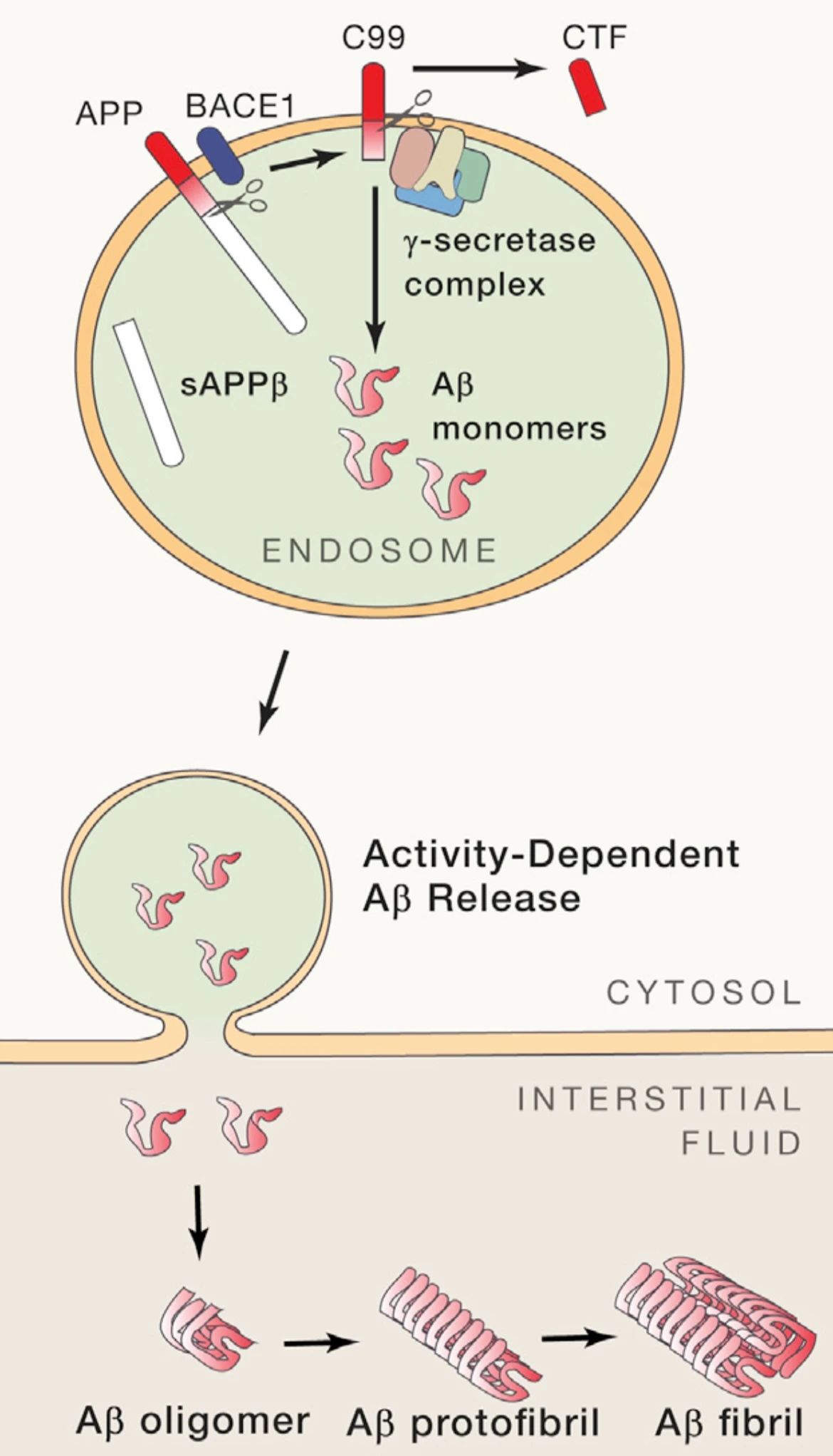
图1. Aβ单体主要在神经元内体中产生并外排至细胞间质中逐步聚集(Justin M. Long and David M. Holtzman1, 2019)
人源γ-secretase由Presenilin, Aph-1, Pen-2和Nicastrin共4个亚基组成,其中Presenilin构成了执行酶活性的功能亚基,它具有PS1和PS2两个同源异构体。目前在PS1, PS2和APP上鉴定出200多个突变与AD相关,绝大部分都集中在PS1上[4]。这些突变中的大部分突变导致APP不正常切割,致使生成Aβ变多或者Aβ42/Aβ40的比率升高[5]。这些发现表明Aβ(特别是Aβ42)是导致AD的重要成因。在这个假设前提下,如能够抑制或者调节γ-secretase的切割活性,或许能够减少Aβ的产生,达到治疗AD的目的[6]。因此理解γ-secretase的分子机理以及药物对γ-secretase的作用机制极为关键。
- 02 -
冷冻电镜单颗粒分析技术解决γ-secretase结构解析重大难题同其他多次跨膜膜蛋白一样,科学家们在很长时间内都无法得到生长良好的γ-secretase蛋白晶体,因此很难通过X-Ray衍射这一传统技术获得γ-secretase的高分辨率结构。同时,面对分子质量高达230kDa,具4个亚基且高度糖基化的成熟γ-secretase,NMR分析也同样力不从心。2013年程亦凡教授与David Julius博士合作,率先应用冷冻电镜单颗粒分析技术(Cryo-EM Single Particle Analysis, Cryo-EM SPA)解析了TRPV1蛋白结构[7],并将其分辨率提升到近原子级别的3.4 Å,为Cryo-EM在结构领域的应用带来了重大突破。同时也让人们意识到,Cryo-EM很可能成为解决高分子量多次跨膜蛋白结构解析难题的新一代技术。
2015年,施一公团队率先在Nature上发表文章,报告了应用Cryo-EM SPA技术解析的γ-secretase近原子级蛋白结构,分辨率达到 3.4 Å[8]。在2018-2019年,施一公团队又先后在Nature和Science上发表文章,利用冷冻电镜解析了人源γ-secretase识别并结合Notch和APP的结构基础,关键区域分辨率分别达到2.7 Å和2.6 Å[9,10]。
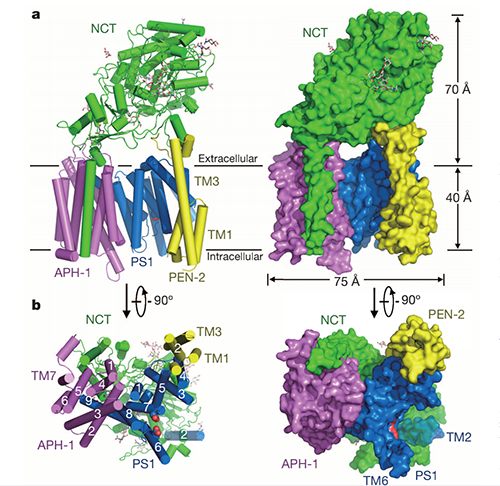
图2. 人源γ-secretase近原子级结构 (Bai.X.-C., et al. 2015)
- 03 -
冷冻电镜高效解析候选药物与γ-secretase复合物结构,领航新一代药物研发
γ-分泌酶抑制剂(GSI)和调节剂(GSM)的开发为AD提供了富有前景的治疗机会。但这些GSI和GSM如何靶向γ-secretase仍然未知。2021年施一公团队在Cell上发表新文章,再次应用Cryo-EM SPA解析了4种候选分子与γ-secretase复合物结构[11]。文章报告γ-secretase分别与3种GSI(Semagacestat, Avagacestat和过渡状态类似物L458)或1种GSM(E2012)结合复合物结构,分辨率2.6–3.1Å,均达到近原子级别。值得注意的是,每个GSI在PS1上均占据底物位置,从而干扰底物的募集。而E2012可与γ-secretase别构位点结合,这可能解释了其调节活性。这些基于冷冻电镜的结构解析工作,有望指导基于药物构效关系(Structure Activity Relationship, SAR)的下一代靶向γ-secretase药物的开发。
本研究首先在体外验证了课题组纯化的重组γ-secretase的活性,并使用Alpha Lisa Assay测量不同条件重组γ-secretase切割C99生成Aβ40的活性,用于评估3种GSI靶向Aβ生成的抑制作用。之后解析γ-secretase分别结合Semagacestat, Avagacestat,L458和E2012后形成的复合物电镜结构。Semagacestat由Eli Lily开发,是第一个进入III期临床评估的GSI[12]。与令人鼓舞的早期结果相反[13],Semagacestat未显示预期的认知改善,却产生严重副作用[14],这归因于Semagacestat抑制了γ-secretase对Notch等其他重要底物的水解[15]。
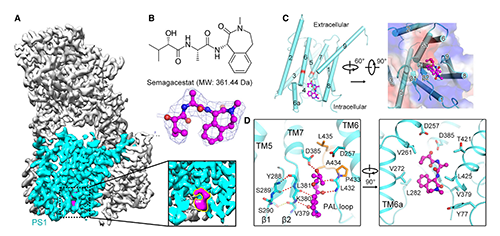
图3. 人源γ-secretase结合Semagacestat的结构基础 (原文图2)
结构解析结果显示:Semagacestat的结合位点与APP-C99或Notch-100的β-链完全相同,位于PS1胞内侧的深腔中(图3, A)。该发现为Semagacestat抑制γ-secretase的活性提供了直接且令人满意的解释。Semagacestat占据该位点可能阻碍PS1和底物间杂化β-片层形成,从而抑制γ-secretase水解底物。Semagacestat与PS1的K380和L432的主链形成4个氢键(图3, D左),这两个残基在γ-secretase识别C99或Notch -100时同样发挥重要作用[9,10],提示Semagacestat与PS1结合模式与PS1的天然底物相似。此外,Semagacestat上芳香环和甲基还与PS1疏水残基的侧链接触并形成生范德华力,但仍然留下了几个小缝隙(图3)。若在这些缝隙中填充其他疏水基团,以填充Semagacestat与V261或V272周围的疏水空间,可能提高新一代抑制分子的特异性和抑制能力。
为了解决Semagacestat底物选择性差、毒副作用显著的问题,Avagacestat作为具有底物选择性的GSI而被开发。相比于Semagacestat,Avagacestat选择性抑制PS1对C99的水解,作用比底物为Notch时强约3-193倍[16]。尽管如此,高剂量的Avagacestat仍然会抑制PS1对Notch的水解并显示毒性。Avagacestat的结合模式如何赋予其底物选择性是个非常有价值的研究问题。复合物的结构显示,虽然Avagacestat与Semagacestat的化学性质完全不同,但Avagacestat与Semagacestat结合位点完全相同(图4, B)。因此Avagacestat同样占据PS1底物结合位点,阻止杂化β-片层的形成从而抑制γ-secretase的活性。
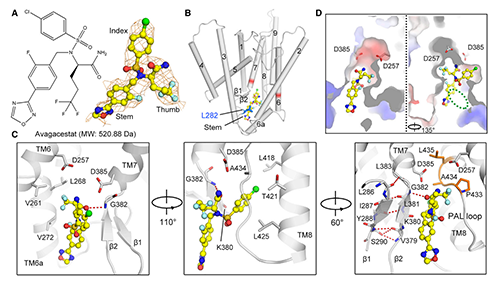
图4. 人源γ-secretase结合Avagacestat的结构基础 (原文图3)
但Avagacestat的具体结合模式与Semagacestat存在很大的区别,这可能是其抑制作用底物选择性的原因。Avagacestat主要与PS1疏水残基互作,只与G382主链酰胺基形成1个氢键(图4, C)。Avagacestat三氟戊酰胺基(图4, A中Thumb区)位于PS1 N端(NTF)V261,L268和V272构成的疏水口袋(图4, C左)。Avagacestat氯苯基(图4, A中Index区)结合在PS1 C端(CTF)与L418,T421,L425和A434间形成范德华力(图4, C右)。Avagacestat恶二唑氟苄基(图4, A中Stem区)一侧与PS1结合(图3D,左),另一侧在空间上相对裸露,因此可用于进一步修饰(图3D,右中绿色圈),以增强抑制强度和特异性。
与Semagacestat和Avagacestat不同,L458是一种竞争性过渡态类似物抑制剂(TSA)。L458直接结合PS1活性位点,在空间上大致与Semagacestat和Avagacestat相同(图5, B)。 L458和位于催化中心的2个天冬氨酸(D257, D385)同时形成氢键,并与与PS1上的其他氨基酸形成另外的5个氢键(图5, C),还能同周围的疏水残基形成范德华力(图5, D)。相较于非TSA抑制剂,L458可以与PS1催化位点上方的口袋进一步结合,以加固抑制剂与催化残基D257和D385之间的氢键。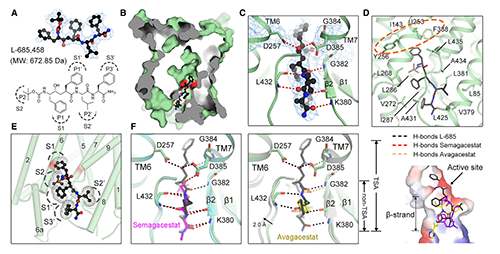
图5. 人源γ-secretase结合L458的结构基础 (原文图5)除GSI以外,GSM也被公认为是一类有吸引力的小分子。GSM很可能会促进Aβ42的进一步切割,从而减少易于聚集的Aβ的产量[17]。与GSI不同,GSM在远离活性位点的别构位点处识别并结合γ-secretase。这提示我们,特定GSI可与GSM配合使用并发挥协同作用,进而实现底物选择性抑制。2013年,Pozdnyakov等曾报道L458可以增强E2012与γ-secretase的结合力[17]。
体外孵育实验表明,单独使用5 nM的 L458或50 mM GSM E2012时仅导致γ-secretase水解C99活性的温和抑制,而二者联用却能几乎完全抑制水解(图6, A)。为阐释L458与E2012对γ-secretase活性调节的协同作用,团队以2.6Å的分辨率获得了同时与E2012和L458结合的重组人源γ-secretase的冷冻电镜结构。E2012插入PS1和NCT界面处的疏水口袋中,并与PS1的loop-1互作(图6, C),覆盖部分底物结合通道(图6, D),从而调节γ-secretase对不同底物的活性。将结合E2012的γ-secretase与APP片段复合起来,发现E2012与C99的N端发生冲突(图6, F&G),这种冲突可能使C99募集更困难或促进C99的解旋退绕。后者可导致C99进一步向下移动到PS1活性位点,并增加将Aβ切割成较短片段的可能性。先前的研究也已证明:存在E2012时Aβ40和Aβ42产量降低,而Aβ38产量升高[17]。
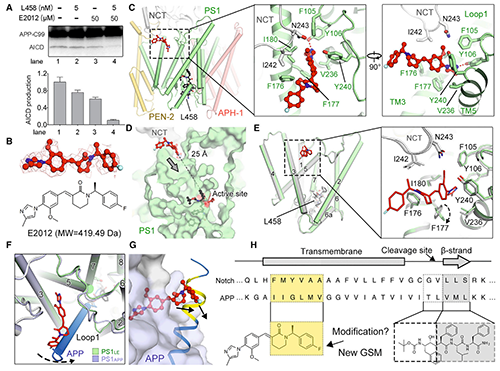
图6. 人源γ-secretase结合E2012的结构基础 (原文图5)
- 总结 -
时至今日,科学家们为了攻克AD已经积累了几十年的努力。然而我们尚未发现任何一种手段可以有效缓解疾病,甚至连延缓认知障碍的进展都很难做到。这在很大的程度上和AD病因不完全明确、相关生物大分子的结构和功能尚未被完全阐明有关。施一公团队这项工作应用Cryo-EM SPA技术,在近原子分辨率上解析了γ-secretase与多种小分子结合后形成复合物的结构。有关结果一方面进一步揭示了现有先导化合物或第一代药物分子的作用机制,另外一方面也可以启发研发人员基于结构对药物分子进行优化设计。随着技术的不断进步,Cryo-EM SPA技术的解析分辨率已经可以达到3Å以下,有关文章在近年也呈现爆发式增长。今后,冷冻电镜必将成为药物发现和优化的强大助力,为守护人类健康做出更大贡献。
- Sherington R., et al. Cloning of the gene bearing missense mutations in early onset familial Alzheimer disease. (1995)
- Takami M., et al. Gamma-Secretase: successive tripeptide and tetrapeptide release from the transmembrane domain of beta-carboxyl terminal fragment. (2009)
- Kidd M. Alzheimer’s Disease–an Electron Microscopical Study. (1946)
- Rogaev E.I., et al. Familial Alzheimer’s disease in kindreds with missense mutations in a gene on chromosome 1 related to the AD type 3 gene. (1995)
- Borchelt D.R., et al. Familial Alzheimer’s disease-linked presenilin 1 variants elevate Abeta1-42/1-40 ratio in vitro and in vivo. (1996)
- Golde T.E., et al. Targeting Aβ and tau in AD, an early interim report. (2010)
- Liao M., et al. Structure of the TRPV1 ion channel determined by electron cryo-microscopy. (2013)
- An atomic structure of human γ-secretase. (2015)
- YangG., et al. Structural basis of Notch recognition by γ-secretase. (2018)
- ZhouR., et al. Recognition of the APP by human γ-secretase. (2019)
- YangG., et al. Structural basis of γ-secretase inhibition and modulation by small molecule drugs. (2021)
- Henley, D.B., et al. Development of Semagacestat (LY450139), a functional gamma-secretase inhibitor, for the treatment of Alzheimer’s disease. (2009)
- Siemers, E.R., et al. Safety, tolerability, and effects on plasma and erebrospinal fluid amyloid-beta after inhibition of gamma-secretase. (2007)
- Doody, R.S., et al. A phase 3 trial of semagacestat for treatment of AD. (2013)
- Doody, R.S., et al. Alzheimer’s Disease Cooperative Study (2015).
- Cha´ vez-Gutie´rrez, L., et al. The mechanism of γ-secretase dysfunction in familial Alz[1]heimer disease. (2012)
- Pozdnyakov, N., et al. γ-secretase modulator (GSM) photoaffinity probes reveal distinct allosteric binding sites on presenilin. (2013)
水木未来(北京)科技有限公司是一家结构和计算驱动的新型药物研发公司,拥有亚太区第一个商业化冷冻电镜服务平台,基于冷冻电镜、计算化学、机器学习和高性能计算核心技术,在小分子、抗体药、蛋白降解、基因治疗等领域推动数字化创新,助力全球创新药企大幅提升药物研发效率和成功率。水木未来2017年创立于清华大学,核心团队由优秀的生命和计算科学家、IT互联网和医药产业专家组成,成立伊始,已成功为来自中国、美国、欧洲的30余家创新药企和顶级科研机构提供了结构生物学和药物发现服务。