根据公告,HQP1351是中国首个三代BCR-ABL靶向耐药CML治疗药物,并有潜力成为耐药CML治疗的“best-in-class”药物。该产品对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果,用于治疗一代、二代TKI耐药的CML患者。此次亚盛医药提交HQP1351的NDA,主要依据该产品两项关键性注册临床研究结果,分别是针对伴有T315I突变的CML慢性期和加速期患者。
CML是一种罕见的恶性血液疾病。这种疾病一般分为3个阶段,慢性期、加速期和急变期,病程可持续几年,但到了急变期常常在半年内死亡。格列卫(伊马替尼)的诞生使这一疾病的治疗有了重大突破,但仍然有相当一部分患者面临耐药或不耐受问题。
BCR-ABL激酶区突变是获得性耐药的重要机制之一,其中T315I突变是常见的耐药突变类型之一,在耐药CML中的发生率可达25%左右。伴有T315I突变的CML患者对目前所有一代、二代BCR-ABL抑制剂均耐药,因此临床上急需可有效治疗T315I突变CML的第三代BCR-ABL抑制剂。HQP1351正是瞄准这一临床急需和市场空缺的治疗领域。
亚盛医药董事长、CEO杨大俊博士表示:“递交HQP1351 NDA对亚盛来说是一个重大的里程碑事件,这将是公司第一个申请上市的产品,也或将成为中国首个上市的第三代BCR-ABL抑制剂。对于现有TKI药物治疗无效的CML患者而言,更安全、有效的治疗药物仍是尚未被满足的、急需的临床需求。我们期待HQP1351的上市能打破这一局面,造福更多患者。”)中具有良好的耐受性,并表现出显著且持久的抗肿瘤活性。87例慢性期CML患者的18个月无进展生存率为94%,在伴有T315I突变的患者中,主要细胞遗传学反应(MCyR)率达到了82%,完全细胞遗传学反应(CCyR)率高达78%。该研究获得2019年ASH年会“最佳研究”(Best of ASH)提名。
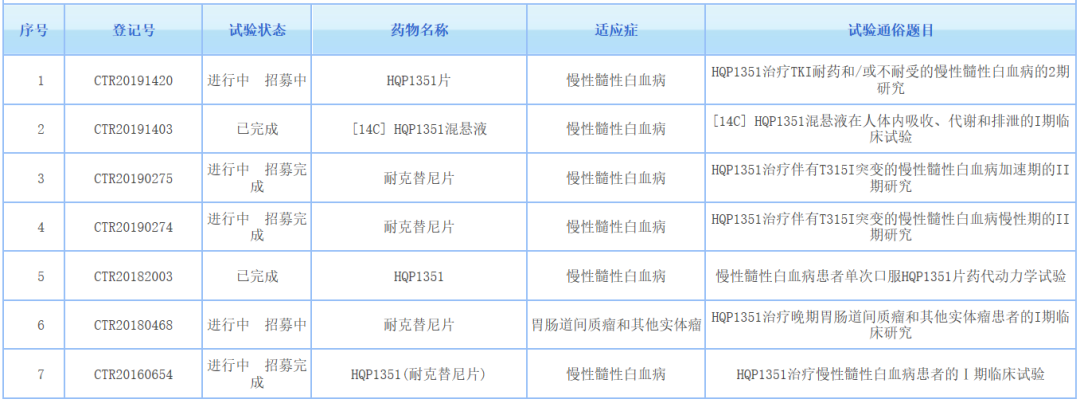
截图来源:药物临床试验登记与信息公示平台
根据药物临床试验登记与信息公示平台,亚盛医药在中国登记开展了7项HQP1351的临床研究,包括两项在T315I突变的慢性期和加速期的CML患者中开展的关键2期临床试验。除了CML,研究人员也正在评估它治疗胃肠道间质瘤(GIST)的潜力。
在美国,HQP1351已获FDA临床试验许可,直接进入1b期临床研究。目前,该产品在的临床开发也在稳步推进中。今年5月,HQP1351相继在美国获得孤儿药资格和快速通道资格,这将加快推进HQP1351在美国乃至全球的临床试验以及上市注册的进度。
亚盛医药已在去年10月登陆港交所。作为该公司核心产品,亚盛医药计划将自全球发售收取所得款项净额约42%(约1.27亿港元)分配到HQP1351的研发和商业化中。同时,为预备HQP1351的生产,亚盛医药还将约3910万港元分配到于苏州兴建GMP生产线。此外,约1510万港元将用于聘请具商业化经验的高级人员,包括销售及营销及监管合规,为商业化HQP1351做准备。
此次为亚盛医药在中国递交的首个NDA,HQP1351也有望成为该公司首个获批上市的产品。我们预祝该产品能顺利通过药监局审评审批,早日为白血病患者带来新的治疗选择。
注:本文旨在介绍医药健康研究进展,不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
参考资料:
[1]亚盛医药核心在研品种HQP1351获得美国FDA孤儿药资格认定,用于治疗慢性髓性白血病, Retrieved May 4, 2020, from https://mp.weixin.qq.com/s/FCDeSlYub8A1eAoUgIKKAg[2]亚盛医药发布2019年度业绩:持续加码创新投入,全球临床开发全面推进. Retrieved March 30,2020, from https://mp.weixin.qq.com/s/Yb3zhLTmYf72dApbM1Mi7w[3]亚盛医药官网. Retrieved Jun 18, 2020, from https://www.ascentagepharma.com/