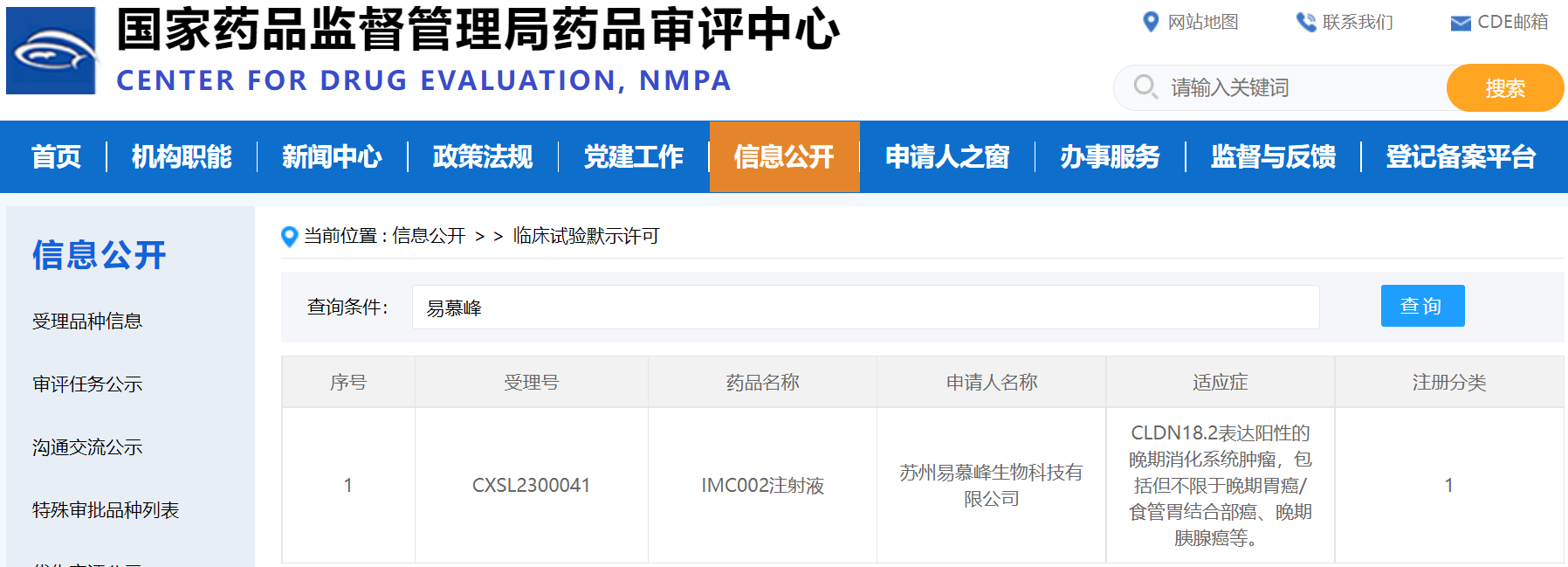
-继被美国FDA批准, IMC002的IND申请已于近日获得中国CDE的默示许可
-IMC002是首个获得中美IND批准的基于高特异性VHH纳米抗体靶向CLDN18.2的CAR-T产品
-高特异性VHH纳米抗体赋予IMC002更优的安全性,正在开展的 IIT 研究已展示了IMC002在人体中优异的耐受性和初步疗效
近日,易慕峰,一家领先的创新细胞治疗产品开发企业,宣布其自研产品IMC002,即靶向CLDN18.2的自体CAR-T产品的IND申请获得中国CDE默示许可,适应症为CLDN18.2表达阳性的晚期消化系统恶性肿瘤,包括但不限于晚期胃癌/食管胃结合部腺癌、晚期胰腺癌等。美国FDA已于今年3月批准了该产品的IND申请。
IMC002是基于高特异性VHH抗体选择靶向CLDN18.2的自体CAR-T细胞治疗药品,在临床前研究以及 IIT 研究中展现出良好的安全性和有效性。高特异性的VHH抗体将赋予IMC002更好的安全性以及潜在更大的临床剂量窗口和适应症范围。
“此次IND申请获得中美监管机构的许可,充分体现了团队的产业化能力和高效的执行能力,使得IMC002成为第一个同时获得中美IND批准的基于高特异性纳米抗体的靶向CLDN18.2 CAR-T产品”,易慕峰创始人兼CEO孙敏敏女士表示:“感谢团队的专业和努力付出,相信我们会开发出更多、更好的细胞治疗产品,为实体瘤患者带来生存获益。”
中国人民解放军总医院肿瘤内科主任医师,IMC002中国 IT 临床试验主要研究者,徐建明教授表示:“靶向CLDN18.2 CAR-T是一个非常有希望的治疗手段,但临床上也容易发生严重的不良反应。易慕峰IMC002采用的纳米抗体序列特异性高,前期数据已显示人体耐受性极佳,有望很好地平衡安全性和有效性,我非常期待尽快推进IMC002的注册临床试验。”
关于易慕峰
易慕峰是一家致力于突破实体瘤治疗,给患者带来长期生存获益的免疫细胞治疗药物开发企业。公司由科学家和产业精英合作组建,于2020年9月启动运营,核心成员成功推动了中国首个CAR-T药物的上市申请,具有丰富的细胞药物开发和产业化经验。
易慕峰从实体瘤治疗痛点和临床获益出发,在全球范围内首次提出“化实体瘤为血液瘤”的临床策略,并在此基础上开发了Peri Cruiser®技术平台,同时还开发了SNR、T-Booster等技术平台,旨在提高CAR-T产品的安全性、对抗肿瘤异质性以及提高扩增和浸润肿瘤的能力。
公司秉承“众擎举易,同心执慕,勇攀高峰”的发展理念,集聚行业英才,携手开发能够给实体瘤患者带来长期生存获益的创新药物。