
近日,霍德生物作为申办方发起的I期注册临床试验,“评价人诱导多能干细胞来源的前脑神经前体细胞注射液(hNPC01注射液)改善缺血性脑卒中偏瘫后遗症的剂量递增、单中心、开放标签的安全性和耐受性的临床研究”,已由湘雅医院杨治权教授团队顺利完成了首例受试者给药和21天的观察。本临床首例入组的受试者在12月7日接受首剂量hNPC01注射液治疗之后,情况平稳,各项指标正常,无手术及围术期的并发症,于术后3日顺利出院并继续康复锻炼。目前,首例受试者给药后已满3周,整体状态平稳,自觉肌力有一定改善,研究团队依照临床试验方案进行了安全审查会议,同时第二、三例患者已入组和完成前期观察,即将按照计划进行给药。
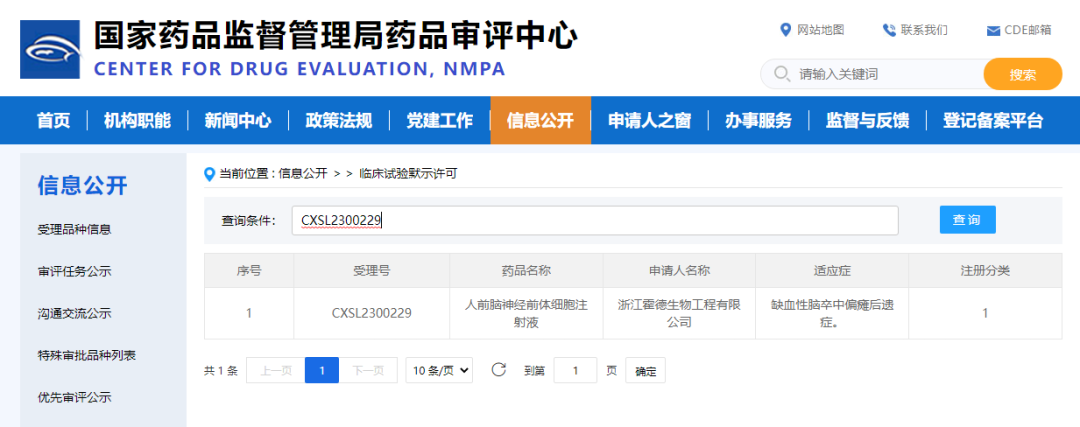
2023年6月底,人诱导多能干细胞来源的hNPC01前脑神经前体细胞注射液用于治疗缺血性脑卒中偏瘫后遗症获CDE临床试验默示许可。这是国际第一个进入注册临床的多能干细胞衍生前脑神经前体细胞产品,也是国内首个获IND批准和完成首例注册临床给药的多能干细胞衍生的神经类细胞产品。
湘雅医院杨治权教授表示:“本次临床试验首例受试者给药已经顺利完成,受试者给药后3周情况良好,且初步显示有肌力改善的趋势。我们将按照临床试验方案的要求,持续监测受试者治疗后情况。我们与霍德生物团队都有非常强的合作精神与共同目标,都希望能推动这些创新的疗法早日惠及更多无药可治的偏瘫患者。”
霍德生物创始人范靖博士表示:“我们在合作中充分感受到了湘雅医院杨治权教授团队及临床试验机构、CRO伙伴对本注册临床试验的鼎力支持和高度的专业性。同时也非常感谢临床志愿者的信任和支持,我们从入组申请和筛选情况中可以看到脑卒中偏瘫患者人群数量之大和治疗意愿之强烈。对于按照计划完成所有剂量入组和给药,公司充满了信心。我们会继续通过内外部伙伴的努力,以高执行力推动高质量的脑缺血初步安全性临床研究,争取早日通过后续的确证性临床为脑出血和脑梗偏瘫后遗症患者提供真正安全、有效和可负担的治疗。”