正如该系列第一篇文章“基因治疗里的七龙珠”中所提到的,一款基因治疗药物要想成功面市,必需经过七大步骤。从疾病相关基因的表达调控,到基因递送载体的选择,再到药物上市审批,每一步都至关重要,且极具挑战性。“路漫漫其修远兮,吾将上下而求索”,在这条收集七龙珠的道路上,一个又一个“孙悟空”为实现基因治疗的理想而努力探索。本节,我们将“溯洄从之”,谈一谈基因治疗的历史,看看从基础技术积累到基因治疗概念的提出,再到第一例临床实验被批准,基因治疗技术是如何一步步由理论变为现实的。

▲ 图1.基因治疗技术的发展脉络
1952年,Joshua Lederberg(约舒亚 · 莱德伯格,1958年诺贝尔生理学或医学奖获得者)和Norton Zinder(诺顿 · 津德尔)发表了名为《Genetic exchange in Salmonella》的文章。他们通过噬菌体将一段鼠伤寒沙门氏菌的DNA转移到了另一个细菌,从而确定细菌除了转化和结合外(转化是指受体菌直接摄取供体菌的DNA片段而获得新的遗传性状的过程;结合是指供体菌和受体菌通过细胞间的暂时沟通,将遗传物质自供体转入受体,使受体获得供体部分遗传性状,由Joshua Lederberg和Tatum在1946年发现。),还存在第三种遗传物质的转移方式:通过病毒粒子将基因从一种微生物转移到另一种微生物,他们称之为“转导”。自此人们有了对病毒可以转移遗传物质的认识,并很快将其扩展应用到真核生物,这奠定了病毒作为基因载体工具的基础,基因治疗中的“长征一号”开始有了草图。

▲ 图2.普遍性转导的过程
在1953年,生物学界出现了一个具有划时代意义的发现:Watson(沃森)和 Crick(克里克)提出了DNA的双螺旋结构模型,确定A(腺嘌呤)与T(胸腺嘧啶)配对、G(鸟嘌呤)与C(胞嘧啶)配对,由此开启了分子生物学时代。在这之后,DNA半保留复制、中心法则等相继被提出,为基因工程的探索提供了理论依据,也奠定了基因治疗中重要的一环 ——“基因表达与调控”的基础。
1962年,Waclaw Szybalski(瓦克劳·斯吉巴尔斯基)发表文章《DNA-mediated heritable transformation of a biochemical trait》。他通过在D98S细胞的两种衍生物HGRPT(+)型细胞和HGRPT(-)型细胞之间进行DNA转导,并在HAT培养基中筛选,发现将HGRPT(+)型的D98S细胞的DNA导入HGRPT(-)型的D98S细胞后,原本不能在HAT培养基中存活的HGRPT(-)型细胞可以正常存活增值了。该研究结果成为哺乳动物细胞中遗传基因转移的第一个有记录的证据,证明遗传缺陷可以通过外源的DNA来修复。为基因治疗提供了进一步的理论基础。
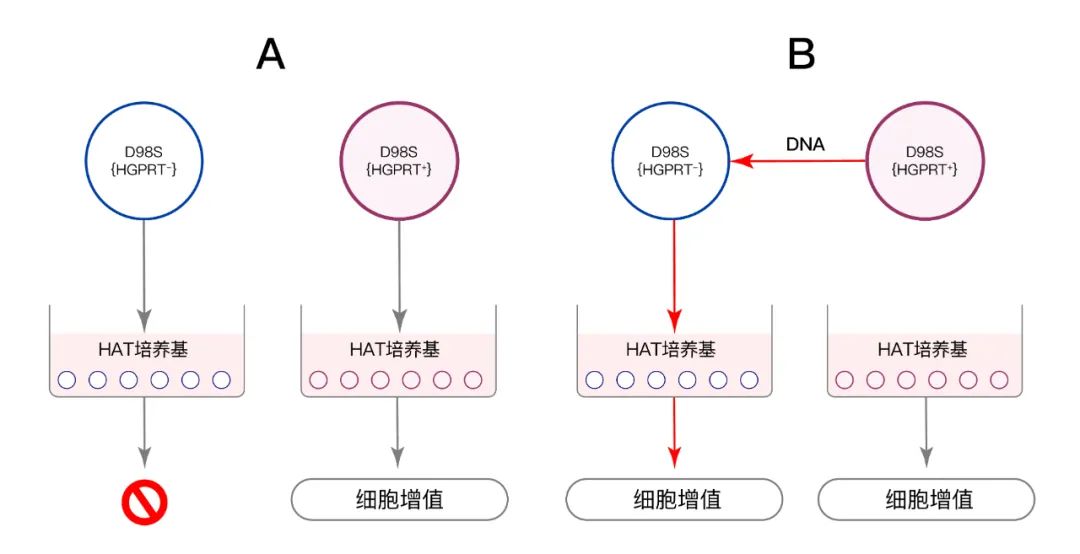
▲ 图3.D98S细胞的遗传基因转移实验
在生物学领域新发现、新事物层出不穷的背景下,Edward Tatum(爱德华·塔特姆)和Joshua Lederberg在1963年提出可利用病毒作为基因转移载体,进行细胞的基因交换和基因优化。
1966年,Edward Tatum在《Molecular biology, nucleic acids, and the future of medicine》中写道:“These will come by epidemiological, immunological, and chemotherapeutic means, by modification and regulation of gene activities, orby means of gene repair or replacement.”。预测基因修复和替代将在疾病治疗中有极大的前途和作用。并且提到,在关键酶、基因编码以及合适的方法确立后,基因就可以在体外有序的合成。再加上已有的DNA摄取和整合技术,基因工程的实现便指日可待了!
但是此时这只是科学家们畅想的美好蓝图,就连Gene Therapy这个名词都还没有出现,显然在技术积累上还需要继续蓄力。正如最初的电子计算机ENIAC(埃尼阿克)发展成如今的电脑,需要有更多的关键性新技术和新工具出现。
迷途中实践-第一个吃螃蟹的人
1968年,Stanfield Rogers(斯坦菲尔德· 罗杰斯)等人用TMV(烟草花叶病毒)作为载体,将聚腺苷酸延伸到病毒RNA上,首次证明了经过人工修饰的基因可以通过病毒载体来介导其转移。在这一结果的基础上,他于1970年进行了第一次人体基因治疗试验。之前已有研究发现,兔感染SPV(肖普乳头状瘤病毒)可以使其皮肤长出肉疣,体内会生成精氨酸酶,导致兔血清中精氨酸水平下降。所以他们推测SPV携带编码精氨酸酶的基因,于是他们尝试通过体内注射野生型SPV来治疗两个患有精氨酸酶缺乏症的女孩。但是不幸的是,试验的结果是阴性的,患者血清精氨酸水平并未监测到明显变化。后来,在对SPV基因组进行测序后,发现SPV基因组实际上并不编码精氨酸酶。此次试验是在对患者基因型、病毒载体特性等方面都不清楚的情况下进行的,更不存在药品监管部门的审批,不得不说是非常大胆且危险的行为,幸而没有对患者造成更多的伤害。但从中不难看出患者对治疗药物迫切的需求以及科学家对基因治疗积极的探索,只是原理还没有清晰,尤其是对基因表达及调控的复杂程度缺乏清晰的认知,技术还远不成熟,伦理监管仍需严格把关。
快还是慢- Gene Therapy如何抉择
20世纪七八十年代是基因工程飞速发展的阶段,一系列与基因修饰和合成相关的酶被发现:包括限制性内切酶、DNA连接酶和逆转录酶等。这些酶的发现促成了第一个重组DNA分子的产生,促成了在大肠杆菌体内表达葡萄球菌乃至哺乳动物的基因,同时也为病毒载体介导的基因治疗技术发展带来了信心。所有人都在热切盼望技术成功的那一天。
“Gene Therapy for Human Genetic Disease? ”Theodore Friedmann(西奥多·弗里德曼) 1972年在 Science 上发表了一篇评论,第一次提出了基因治疗的概念,同时也表达了对基因治疗未来发展的憧憬和担忧。在当时,已知由基因缺陷导致的遗传病就有1500多种,而且大部分是罕见病,他们面对的是更少的研究投入和更渺茫的治愈可能。用外源的“good”基因代替有缺陷的基因,通过基因治疗的手段去治疗疾病,将给这些患者带来福音。然而,虽然基因治疗的概念蓝图早已被画出,但是病毒载体的修饰、基因表达的调控(靶向性,整合效率等)、免疫原性等问题都是不得不去思考和重视的关键因素。他提倡建立伦理-科学的标准,来规范和约束大家的激进尝试:(1)清楚疾病发生原因;(2)考虑病人的异质性,看似症状相同的遗传疾病在不同的个体中具有不同的遗传方式;(3)外源性DNA载体质量和安全性保证;(4)在实验动物上进行广泛的研究;(5)对于某些遗传性疾病,先利用体外培养的患者皮肤成纤维细胞做测试。基因治疗最终目标是尽可能实现患者的利益,使用之前要充分评估其风险,因此病因和治疗机制必须明确,不成熟地应用不被充分理解的技术,会造成严重的后果。总之伦理的规范、科学的依据才是基因治疗实现应用的前提。
快就是慢- 一次失败的实验
1979年, Martin Cline(马丁·克莱因)利用磷酸钙转染的方式,成功将人免疫球蛋白基因导入小鼠的骨髓细胞,用于免疫球蛋白基因缺陷小鼠的治疗。除此之外,他还将外源基因(二氢叶酸还原酶和单纯疱疹病毒胸苷激酶)导入小鼠骨髓干细胞,而这些修饰过的细胞能够在其他小鼠的骨髓中部分再生。受到这些结果的鼓舞,1980年Martin Cline打算在病人身上测试这种治疗方法,他向UCLA (加州大学洛杉矶分校)申请使用同样的方法治疗β-地中海贫血患者。在本系列之前的文章中已经提到过,β-地中海贫血是由于血红蛋白中β –珠蛋白的缺失(缺陷)造成的,通常会导致严重的甚至危及生命的贫血,当时对此唯一的治疗方案是依赖于频繁输血。之所以选择地中海贫血是由于人们对它的研究较多,以为其发病机制已比较清楚(实际上地贫的病因和治疗极其复杂)。然而,他的申请并没有得到审查委员会的许可,但是他还是启动了这项研究!从两名β-地中海贫血重症患者身上抽取了骨髓细胞,并对其进行改造和回输,一名患者在意大利接受治疗,另一名在以色列接受治疗。但是很可惜这次试验因为没有使患者的临床症状得到缓解而宣告失败,Martin Cline也因开展未经批准的人体实验受到了严厉处罚和广泛指责。这次试验是第一次尝试利用重组DNA进行基因治疗,虽然已经意识到对细胞进行基因修饰在基因治疗中的重要性,但显然低估了其复杂性。此次事件后,体细胞基因治疗一度受到冷落。
进入春天- 监管下的基因治疗
直到1988年12月,RAC (重组DNA咨询委员会) 正式批准了Steven Rosenberg(史蒂文 • 罗森伯格)关于将外源基因导入人体的临床方案。在之前的研究中,Rosenberg发现通过 TILs (肿瘤浸润性淋巴细胞)和白介素-2可以治疗转移性黑色素瘤,于是他从转移性黑色素瘤患者身上提取了TILs,并利用逆转录病毒作为载体对其进行了抗性标记,想要探究TILs浸润和它们对肿瘤治疗的有效性之间是否存在临床相关性。后来再看,这次试验仅是用一个报告基因构建的表达载体,了解标记基因在人体内的分布和表达情况,可以看作一个基因治疗对照实验,并不是真正的基因治疗。
1990年,史上最早被正式批准的基因治疗人体试验开始了。William French Anderson(威廉·弗兰奇·安德森)医生领衔开展了针对重症联合免疫缺陷病(SCID)的基因治疗。SCID是由ADA(腺苷脱氨酶)缺陷或白介素受体(IL-2R最常见)功能障碍所致。ADA-SCID为常染色体隐性遗传病,两条染色体上的ADA基因都发生了突变,导致ADA蛋白缺失,从而引起细胞损伤或死亡,致细胞体液免疫缺陷,人体内的免疫T细胞会很快死去,这相当于身体对细菌和病毒开放,非常危险。两名ADA-SCID的患病儿童接受了此次基因治疗,研究人员从患儿血液中提取了白细胞,并在体外利用逆转录病毒载体将能够正确编码ADA的基因插入患者的白细胞基因组中,然后进行白细胞回输。之后的检测表明, 其中一位受试者Ashanti DeSilva(阿莎提·德席尔瓦)体内的白细胞确实可以正确地合成ADA了,在6个月后她的T细胞水平便恢复了正常值。尽管这种药物显著减轻了Ashanti的症状,但是并没有完全治愈她,直到现在她仍需定期接受 PEG-ADA (聚乙二醇腺嘌呤脱氨酶)的替代治疗,因此人们对本次基因治疗的效果仍存在一些争议。但无论如何这次试验意义重大,是一个典型的成功案例,也让基因治疗正式走进了普通大众的视野,基因治疗在理论、技术、政策上全面的进入了春天。
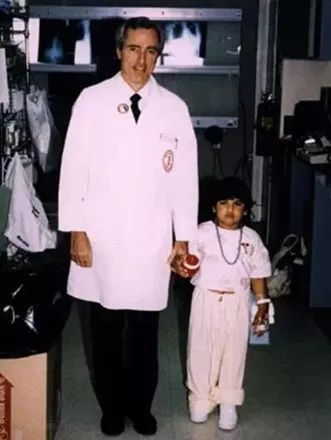
▲ 图4. Anderson医生和Ashanti
60年代到90年代,从提出基因优化的概念到第一例临床实验的审批,短短三十年的时间,基因治疗便从理论走向现实;而后从1990年直到现在,又是三十年过去了,后续的研究应用又是如何站在巨人的肩膀上昂首向前的?基因治疗“道阻且长”,但我们充满期待与信心,且看下回再与您共同回顾!
【参考文献】:
Buchanan,B.G. Joshua Lederberg (1925-2008); 2008.
DunbarCE, High KA, Joung JK, Kohn DB, Ozawa K, Sadelain M. Gene therapycomes of age. Science 2018; 359(6372):eaan4672.
FriedmannT, Roblin R. Gene Therapy for Human Genetic Disease? Science 1972;175(4025): 949-955.
MedicineIO. Microbial Evolution and Co-Adaptation: A Tribute to the Life and ScientificLegacies of Joshua Lederberg: Workshop Summary. 2009.
ShahryariA, Saghaeian Jazi M, Mohammadi S, Razavi Nikoo H, Nazari Z, Hosseini ES, et al. Development and Clinical Translation of Approved Gene Therapy Productsfor Genetic Disorders. Front Genet 2019; 10:868.
SzybalskiSW. GENETICS OF HUMAN CELL LINES, IV. DNA-MEDIATEDHERITABLE TRANSFORMATION OF A BIOCHEMICAL TRAIT. Proceedings of theNational Academy of Sciences of the United States of America 1962;48 (12) :2026-2034.
WirthT, Parker N, Yla-Herttuala S. History of gene therapy. Gene 2013;525(2): 162-169.